Original en RebelEM, por Salim Rezaie: COVID-19: Thrombosis and Hemoglobin
Traducido por Fernanda Guevara
El nuevo coronavirus 2019 se reportó por primera vez en Wuhan, China, a finales de diciembre del 2019. El brote fue declarado una emergencia de salud pública de interés internacional en enero del 2020 y el 11 de marzo del 2020, el brote fue declarado una pandemia mundial. La propagación de este virus hasta ahora ha sido global con mucha atención por parte de medios comunicativos. El virus se ha denominado SARS-CoV-2 y la enfermedad que causa se conoce como enfermedad por coronavirus 2019 (COVID-19 por sus siglas en ingles). Este nuevo brote ha estado produciendo mucha histeria y falsas verdades han estado siendo difundidas, sin embargo, los datos que rodean la biología, la epidemiología y las características clínicas están creciendo a diario, lo que lo convierte en un objetivo móvil. Esta publicación servirá como un resumen con respecto a la trombosis y hemoglobina en la enfermedad por coronavirus 2019 (COVID-19).
Tromboembolismo venoso (TEV):
- COVID-19 probablemente esté causando un estado de hipercoagulabilidad, sin embargo, la prevalencia de TEV aguda sigue siendo un área en evolución.
- El dímero D es un reactivo de fase aguda no específico
- Datos limitados sugieren que la trombosis microvascular pulmonar puede desempeñar un papel en la insuficiencia respiratoria progresiva.
- Los primeros datos sugieren altas tasas de TEV sin profilaxis farmacológica.
- La mayoría de la evidencia es limitada debido a que se trata de ensayos retrospectivos pequeños.
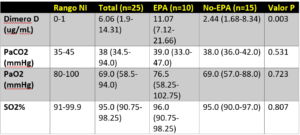
- Un estudio retrospectivo realizado en un solo centro con 25 pacientes con COVID-19 a quienes se les realizo un angio-TAC pulmonar [1]
- No se encontraron diferencias significativas entre los grupos de embolismo pulmonar agudo (EPA) positivos y de embolismos pulmonar aguda (EPA) negativos para todos los datos de laboratorio, excepto el dímero D.
- 20 pacientes tratados con HBPM 0,6 mg / kg por 12 horas
- Independientemente de los hallazgos de EPA en el angio TAC, todos los pacientes tuvieron una disminución en los niveles de dímero D.
- 3 pacientes se les realizo un angio TAC de seguimiento después del inicio de HBPM y todos tenían lesiones de EPA más pequeñas en comparación con el primer angio TAC.
- Todos los defectos de llenado se encontraron en pequeñas ramas.
- Solo se obtuvo US de extremidades inferiores en un paciente en este estudio y, por lo tanto, no se conoce la tasa de TVP.
- 3 pacientes con COVID-19 se les evaluó para anticuerpos anti-fosfolípidos [2]
- Se detectaron anticuerpos IgA anticardiolipina y anticuerpos anti-β2-glucoproteína I IgA e IgG
- No se detectó anticoagulante lúpico en ninguno de los pacientes
- Revisión retrospectiva de dos hospitales en China arrojo [4]
- 191 pacientes con COVID-19
- El dímero D> 1,500 tuvo mayor mortalidad en comparación con los pacientes con valores más bajos de dímero D.
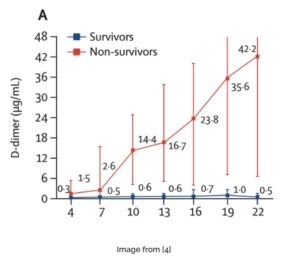
Sobrevivientes en azul
No sobrevivientes en rojo
81 pacientes de la UCI con COVID-19 [6]
- Se deseaba determinar la incidencia de TEV en pacientes con neumonía grave por COVID-19
- 81 pacientes con neumonia grave por COVID-19 ingresaron a la UCI en China
- Los parámetros de coagulación y los datos de las extremidades inferiores de ultrasonido (US). Se recopilaron retrospectivamente.
- 20/81 (25%) tenían TVP de extremidades inferiores sin profilaxis para TEV.
- 8/20 (40%) de los pacientes con TVP de extremidades inferiores murieron.
- Usando un límite en parámetros de dímero D> 1.5ug / mL para predecir tromboembolismo venoso:
- Sensibilidad = 85%
- Especificidad = 88.5%
- VPN = 94.7%
- VPP = 70.8%
184 pacientes en 3 hospitales holandeses [8]
- Se evaluó la incidencia del resultado compuesto de embolismo pulmonr agudo sintomático, TVP, accidente cerebrovascular isquémico, infarto de miocardio o embolia arterial sistémica de pacientes con COVID-19 ingresados en la UCI.
- Todos los pacientes recibieron al menos dosis estándar de tromboprofilaxis
- Incidencia acumulada de trombosis = 31%
- Embolismo pulmonar complicación trombótica más común = 25 puntos (81%)
- Opciones para profilaxis:
- HBPM nadroparina 2850IU / d
- >100kg = HBPM nadroparina 5700IU / d
- Predictores independientes de complicaciones trombóticas = TTPa prolongado a > 5 segundos y PT >3 segundos (aHR 4.1; IC 95% 1.9 – 9.1)
Serie de casos de 4 autopsias de pacientes infectados con COVID-19 en Nueva Orleans [9]
- Todos los casos tuvieron descompensación respiratoria repentina antes de llegar a la sala de urgencias.
- Los hallazgos de laboratorio notables fueron ferritina, fibrinógeno y PT elevados
- Los dímeros D extraídos cerca del momento de la muerte en 2 pacientes fueron elevados: 1200 – 2900ng / mL
- Hallazgos en la patología macroscópica:
- Las arterias pulmonares en el área del hilio estaban libres de tromboembolias.
- El parénquima periférico tenía regiones de hemorragia de color oscuro con demarcación focal.
- En algunos casos, trombos pequeños y firmes estaban presentes en secciones de parénquima pulmonar periférico.
- Hallazgos patológicos microscópicos:
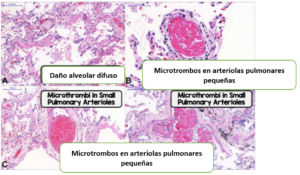
- Los pequeños vasos contenían plaquetas y pequeños trombos.
- Áreas dispersas de daño alveolar difuso.
- La formación de trombos de vasos pequeños se observó en la periferia pulmonar en muchos casos
- Hallazgo notable: falta de infección secundaria significativa en todos los casos
Evidencia patológica de fenómenos trombóticos pulmonares en COVID-19 grave [13]:
- Un grupo de Sao Paulo, Brasil, realizó autopsias mínimamente invasivas en casos fatales de COVID-19 para caracterizar la patología y la patogénesis.
- Usó una autopsia mínimamente invasiva basada en ultrasonido (MIA-US) que toma muestras de tejidos de varios órganos y minimiza los riesgos del procedimiento de autopsia.
- Este es un conjunto preliminar de resultados de la autopsia que busca información sobre la relación entre COVID-19 y CID.
- Los autores no tuvieron acceso a grandes vasos y no pueden confirmar o excluir TEP.
- Se examinaron 10 casos fatales totales
- Histología:
- Intensos efectos citopáticos virales epiteliales que involucran epitelio alveolar y de vías aéreas pequeñas.
- Número variable de pequeños trombos fibrinosos en arteriolas pulmonares pequeñas en áreas de parénquima pulmonar dañado y preservado en 8/10 casos.
- Tumefacción endotelial (hinchazón) y grandes cantidades de megacariocitos pulmonares en capilares pulmonares (indican la activación de la cascada de coagulación).
- Pocos y pequeños focos de hemorragia alveolar e infartos pulmonares.
- Signos de neumonía bacteriana secundaria observados en 6/10 casos.
Conclusión: este informe respalda el concepto de estado hipercoagulativo, que muestra una alta frecuencia de microtrombosis pulmonar.
Prevalencia de TEV en pacientes ingresados consecutivamente a la UCI en Italia [14]
- 54 pacientes en total
- Todos los pacientes tratados con HBPM profiláctica ajustada al peso corporal desde el ingreso
- El 22,2% de los pacientes ingresados en la UCI tenían TEV
- 8 TVP
- 1 trombosis de la válvula tricúspide
- 2 embolismos pulmonares sub-segmentarias
- 1 paro cardíaco (actividad eléctrica sin pulso con dilatación de VD)
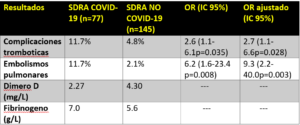
Pacientes con SDRA por COVID-19 de 4 UCIs (2 centros) en Francia [15]
- Se utilizó un estudio cohorte prospectivo histórico de pacientes con “SDRA no COVID-19” (PMID: 27066082).
- Todos los pacientes estaban en anticoagulación profiláctica o terapéutica.
- Resultado primario: Comparación de la aparición de eventos trombóticos (TVP, EP, IM, isquemia mesentérica, isquemia de miembros inferiores, AVC) entre pacientes con SDRA COVID-19 y pacientes históricos con SDRA no COVID-19.
- 150 pacientes con COVID-19.
- Complicaciones trombóticas relevantes: 64/150 (42.7%)
- Principalmente embolismos pulmonares= 25/150 (16.7%)
- Troncular = 9
- Lobar = 8
- Segmental = 5
- Subsegmental = 3
- Recibimiento de terapia de reemplazo renal continuo que desarrolló coagulación de circuito = 28/29 (96.6%)
- Ningún IM durante la estancia en la UCI en este estudio
- Solo 4 pacientes (2.7%) presentaron complicaciones hemorrágicas
- 2 con traumatismo craneal reciente antes de la admisión a la UCI
- Niveles elevados de dímero D y fibrinógeno: > 95% de pacientes
- Anticoagulante lupico circulante positivo: 50/57 (87.7%)
SDRA COVID-19 versus SDRA histórico no COVID-19
Grupos similares a los del inicio del estudio:
CID:
- Ningún paciente con COVID-19 fue diagnosticado con CID usando el puntaje “abierto” de la Sociedad Internacional de Trombosis y Hemostasia.
- 6 pacientes con COVID-19 fueron diagnosticados con CID usando el puntaje JAAM-DIC
- 22 pacientes con COVID-19 fueron diagnosticados con CID usando el puntaje SIC
Limitaciones:
- No existe una evaluación estandarizada sistemática de los eventos tromboembólicos, por lo tanto, los eventos tromboembólicos pueden subestimarse en este estudio.
- La dosificación profiláctica fue de 4000 UI / día para heparina de bajo peso molecular o, si está contraindicada, heparina no fraccionada a 5-8 U / kg / hora. La HBPM puede estar subdosificada en pacientes con IMC más altos.
Conclusión: a pesar de la anticoagulación, un gran número de pacientes con SDRA secundario a COVID-19 en la UCI desarrollaron complicaciones trombóticas potencialmente mortales. Deben considerarse objetivos de anticoagulación más altos siguiendo los niveles de anti-Xa en pacientes críticos con SDRA-COVID-19.
Profilaxis de Trombovenosa:
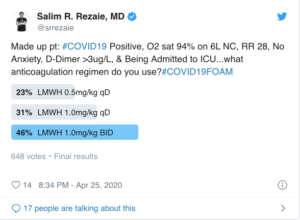
“Paciente hipotético: #COVID19 positivo, O2 sat 94% con 6L por nasocanula, RR28, sin ansiedad, dimero D >3ug/L, siendo admitida a la UCI… qué régimen de anticoagulación usarías? #COVID19FOAM
23% HBPM 0.5 mg/kg c/día
31% HBPM 0.1 mg/kg c/día
46% HBPM 1.0 mg/kg c/día
- No es necesario realizarle una tomografía computarizada a todos los pacientes que ingresan porque todos deberían estar bajo algún tipo de anticoagulación, ya sea que haya diagnosticado definitivamente embolismo pulmonar o no.
- La mayoría de los pacientes tendrán microtrombos
- Los pacientes también pueden tener trombosis arterial.
- Análisis retrospectivo de 449 pacientes consecutivos con COVID-19 grave [5]
- 94/99 pacientes recibieron HBPM (40-60 mg / día) durante 7 días o más
- Valores de dímero D y PT se correlacionaron con la mortalidad en 28d
- En pacientes con coagulopatía inducida por sepsis (SIC por sus siglas en ingles),con scores de ≥4, la mortalidad se redujo significativamente con la anticoagulación (40.0% vs 64.2%, P = 0.029)
- En pacientes con dímero D> 3.0ug / mL (6 veces sobre límite superior de la normalidad) la anticoagulación resultó en una reducción del 20% en la mortalidad (32.8% vs 52.4%, p = 0.017)
- La Sociedad Estadounidense de Hematología recomienda que todos los pacientes hospitalizados con COVID-19 reciban tromboprofilaxis con HBPM o fondaparinux (sugerido sobre la heparina no fraccionada para reducir el contacto) a menos que se considere que el paciente tiene un mayor riesgo de sangrado. En pacientes con antecedentes de trombocitopenia inducida por heparina (HIT), use fondaparinux
Guía provisional de la Sociedad Internacional de Trombosis y Hemostasia (ISTH por sus siglas en ingles) sobre el reconocimiento y manejo de la coagulopatía en COVID-19 [7]
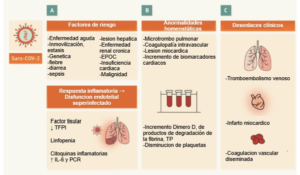
- Una de las características más significativas de mal pronóstico de los pacientes con COVID-19 gravemente enfermos es el desarrollo de coagulopatía.
- Una guía de orientación fue desarrollada para la estratificación del riesgo al ingreso de los pacientes con COVID-19, así como el manejo de la coagulopatía que puede desarrollarse.
- Los pacientes con un dímero D elevado (es decir, un aumento de 3 a 4 veces sobre el límite, esto fue definido arbitrariamente necesitarán ingresar al hospital.
- El monitoreo de la disminución de los niveles de fibrinógeno más adelante en la evolución de la enfermedad (es decir, los días 10-14) puede ser útil para determinar si un paciente ha desarrollado coagulación intravascular diseminada (CID)
- Se debe considerar la HBPM en TODOS los pacientes (incluidos los no críticos) que requieren ingreso hospitalario por infección por COVID-19, en ausencia de contraindicaciones:
- Sangrado activo
- Recuento de plaquetas <25 × 109 / L
- Monitoreo recomendado en insuficiencia renal grave
- PT o aPTT anormales no son una contraindicación
- La HBPM puede tener propiedades antiinflamatorias que pueden ser un beneficio adicional en la infección por COVID-19.
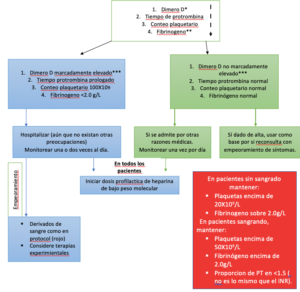
Algoritmo para el manejo de la coagulopatía en COVID-19 basado en marcadores de laboratorio simples.
* La lista de marcadores se da en orden decreciente de importancia.
** La realización de mediciones de fibrinógeno puede no ser factible en muchos laboratorios, pero el monitoreo de los niveles puede ser útil después de la admisión del paciente.
*** Aunque no se puede definir un límite específico, un aumento de 3-4 veces en los valores de dímero D puede considerarse significativo. Cualquiera de los valores en esta tabla puede considerarse significativo.
Mis pensamientos / flujo de trabajo para pacientes positivos por COVID-19 con HBPM admitidos:
- Todos los pacientes ingresados con COVID-19 deben recibir tromboprofilaxis en el servicio de urgencias en ausencia de contraindicaciones (sangrado activo o recuento de plaquetas <25,000)
- La verdadera prevalencia de trombosis venosa en el servicio de emergencias es desconocida en este momento
- Decisiones de tratamiento y dosificación:
- Sin coágulo (TVP / EP) + dímero D <1 – 2ug / L = Lovenox 0.5mg / kg qD (dosis de profilaxis)
- Sin coágulo (TVP / EP) + dímero D> 1 – 2ug / L = Lovenox 1.0mg / kg qD (dosis de profilaxis más alta)
Esta es una recomendación muy controversial, dependerá de su institución y puede cambiar según los datos más recientes.
- Coágulo (TVP / EP) + cualquier dímero D = Lovenox 1mg / kg BID (dosis de tratamiento)
- Si tiene antecedentes de trombocitopenia inducida por heparina (HIT por sus siglas en ingles) o trombocitopenia y trombosis inducida por heparina (HITT por sus siglas en ingles), use una alternativa sin heparina.
- Si la anticoagulación está contraindicada, use profilaxis mecánica
- Los pacientes que tomen anticogulantes orales o warfarina en el ambiente ambulatorio (fibrilación auricular, antecedentes de TEV, válvula mecánica) deben cambiarse a dosis de tratamiento HBPM.
- Anticoagulación en mi tienda (San Antonio, TX):
- Para pacientes hospitalizados:
- Alto riesgo: Dímero D> 6x límite superior normal (LSN) (> 3ug / L) = Anticoagulación terapéutica (TAC)
- Bajo riesgo: Dímero D <6x límite superior normal (<3ug / L) = Dosificación profiláctica
- Para pacientes ambulatorios (para los de alto riesgo para TVP / EP plan de alta):
- Si no hay TVP / EP y en TAC durante la estadía en el hospital + Riesgo alto (D-Dimer Still> 6x LSN) -> 2 semanas de anticoagulación después del alta
- Si no hay TVP / EP y en TAC durante la estancia hospitalaria + Alto riesgo (Dímero D <6x LSN) -> No hay anticoagulación después del alta
- Si se confirma la TVP / EP, entonces el protocolo provocado normal -> Anticoagulación por 3 – 6meses
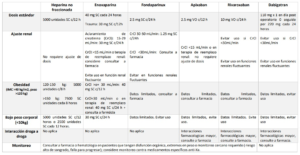
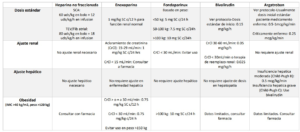 Dosis Guidelines de Massachusetts General Hospital [link]
Dosis Guidelines de Massachusetts General Hospital [link]
- PDF del Hospital General de Massachusetts: Mass Gen Anticoag Recs
Recomendaciones de la JACC (publicadas el 17 de abril de 2020) [11]
- Los datos derivados de las recomendaciones son principalmente de análisis pequeños y retrospectivos.
- Aunque la edad avanzada y las comorbilidades, como la enfermedad cardiovascular, tienen un mayor riesgo de enfermarse gravemente, los pacientes jóvenes y sanos también corren el riesgo de desarrollar
- Los niveles elevados de dímero D están asociados con un mayor riesgo de requerir ventilación mecánica, ingreso en la UCI o muerte.
Estratificación de riesgo / profilaxis hospitalaria:
- La anticoagulación profiláctica reduce el riesgo de TEV en pacientes hospitalizados.
- La elección de modelos específicos de evaluación de riesgos variará entre los sistemas de salud.
- Las HBPM diarias profilácticas se recomiendan sobre la heparina no fraccionada subcutánea dos veces al día (para reducir el uso del equipo de protección personal y la exposición del personal).
- Si la profilaxis farmacológica está contraindicada, se debe considerar la profilaxis mecánica del TEV (compresión neumática intermitente) en pacientes inmovilizados.
Profilaxis de TEV extendida (después del alta)
- La profilaxis extendida con HBPM o anticoagulantes orales puede reducir el riesgo de TEV pero conlleva un riesgo de sangrado.
- No existen datos específicos para COVID-19, sin embargo, es razonable emplear una estratificación de riesgo individualizada para el riesgo trombótico y hemorrágico, seguida de la consideración de profilaxis extendida (hasta 45 días) para:
- Pacientes con riesgo elevado de TEV: movilidad reducida, comorbilidades como cáncer activo y dímero D elevado> 2 veces sobre el límite superior que tienen bajo riesgo de hemorragia
- Los pacientes en cuarentena con COVID-19 leve pero con comorbilidades significativas, o para pacientes sin COVID-19 que son menos activos debido a la cuarentena requiere más estudio
- En ausencia de datos científicos de alta calidad, la profilaxis farmacológica debe reservarse para aquellos con mayor riesgo de TEV (movilidad limitada, antecedentes de TEV o neoplasia malignidad activa)
Diagnóstico de TEV:
- El dímero D elevado es un hallazgo común en pacientes con COVID-19 y NO garantiza actualmente un estudio de rutina para el tromboembolismo venoso agudo en ausencia de manifestaciones clínicas u otra información de apoyo.
Rol de la anticoagulación terapéutica empírica sin diagnóstico de TEV:
- Algunos médicos utilizan anticoagulación parenteral terapéutica a dosis intermedias o dosis completa.
- Los datos existentes sobre esto son muy limitados, principalmente basados en análisis de subgrupos.
- La dosis óptima en pacientes con COVID-19 grave sigue siendo desconocida.
Terapia médica para el tromboembolismo venoso (TEV):
- La anticoagulación terapéutica es la base del tratamiento de TEV.
- Se prefiere la heparina no fraccionada(HNF) parenteral ya que puede ser retenida temporalmente y no tiene interacciones farmacológicas conocidas con las terapias de investigación de COVID-19.
- Preocupaciones con la HNF: el tiempo para lograr un TTPa terapéutico, el aumento de la exposición de los trabajadores de la salud por las frecuentes extracciones de sangre.
- Las HBPM pueden ser el agente preferido en pacientes que probablemente no necesiten procedimientos.
- Los anticoagulantes directos orales carecen de la necesidad de monitoreo, facilitando la planificación del alta y manejo ambulatorio
- Para los pacientes que están listos para el alta, se preferiría anticoagulantes directos orales o la heparina de bajo peso molecular para limitar el contacto de los pacientes con los servicios de atención médica.
Terapias Intervencionistas para TEV:
- El uso de terapias dirigidas por catéter debe limitarse a las situaciones más críticas.
- Los pacientes de riesgo intermedio que estén hemodinamicamente estables (TEP submasivo) deberían ser tratados inicialmente con anticoagulación y monitorización cercana. El deterioro adicional debe recibir fibrinólisis sistémica de rescate con opciones dirigidas por catéter como alternativa.
- Los pacientes de alto riesgo hemodinamicamente inestables (TEP masivo) deben tratarse con fibrinólisis sistémica con terapias basadas en catéteres reservadas para escenarios que no son adecuados para la fibrinólisis sistémica. También puede considerarse ECMO sobre el laboratorio de cateterismo o una sala de operaciones.
Síndromes coronarios agudos incidentales:
- Las elevaciones en troponinas cardíacas o anormalidades en el ECG están asociadas con una enfermedad grave, sin embargo, no todas estas anormalidades se deben a un SCA trombótico.
- En el SCA verdadero debido a la ruptura de la placa (IAM tipo I), se recomienda el tratamiento antiplaquetario doble (DAPT por sus siglas en inglés) y la anticoagulación a dosis completa, a menos que haya una contraindicación.
- En pacientes que se perciba un riesgo elevado de sangrado, se debe considerar el clopidogrel dado que las complicaciones hemorrágicas no son infrecuentes.
- Es razonable continuar la terapia médica óptima y diferir los procedimientos cardíacos no urgentes, a fin de preservar el equipo de protección personal (EPP), los recursos hospitalarios, incluidas las camas para hospitalización en piso y camas en la UCI.
- Se debe considerar un umbral bajo para usar ecocardiograma transtoracico (ETT) para identificar anormalidades en el movimiento de la pared antes de la activación del laboratorio de cateterismo.
- La consideración de la terapia fibrinolítica en pacientes seleccionados con SCAEST es razonable, sin embargo, en el contexto de la miocarditis, la terapia fibrinolítica debe usarse con precaución.
Enfermedad crítica y manejo de agentes antitrombóticos:
- La inmovilidad, la inflamación sistémica, la ventilación mecánica y los CVC contribuyen al riesgo de TEV dentro de las UCI.
- La anticoagulación parenteral se recomienda en la mayoría de los casos. La heparina no fraccionada puede usarse en el contexto de procedimientos previstos o en pacientes con deterioro de la función renal. Si no se anticipan procedimientos urgentes, las heparinas de bajo peso molecular son una alternativa razonable.
- Actualmente, existen datos insuficientes para recomendar objetivos de anticoagulación en pacientes en ECMO.
Consideraciones adicionales:
- Datos insuficientes para recomendar umbrales de transfusión que difieren de los recomendados para otros pacientes críticos. Si se planean procedimientos invasivos, se puede considerar la transfusión profiláctica de plaquetas, PFC, fibrinógeno y concentrado complejo de protrombina.
- El manejo dirigido de la temperatura puede exhibir prolongaciones de PT y PTTa sin evidencia de sangrado. Actualmente no se recomienda la corrección de la coagulopatía en pacientes no seleccionados sin hemorragia manifiesta.
CID:
- El diagnóstico se establece mejor utilizando la calculadora de puntaje ISTH DIC.
- Se recomienda controlar el recuento de plaquetas, PT, dímero D y fibrinógeno.
- La profilaxis con HBPM puede disminuir la generación de trombina y modificar el curso de la CID.
- Los agentes antiplaquetarios de acción prolongada deben suspenderse en la mayoría de los pacientes con CID a menos que sean realmente necesarios (es decir, SCA reciente o colocación de un stent)
Manejo del sangrado en CID:
- El sangrado manifiesto es poco frecuente, pero si ocurre:
- Mantenga el recuento de plaquetas > 50 × 109 / L con sangrado activo o > 20 × 109 / L en aquellos con alto riesgo de sangrado o que requieren procedimientos invasivos.
- Plasma fresco congelado 15 – 25mL/kg) en pacientes con sangrado activo con relaciones prolongadas de PT y/o PTTa (> 1.5x normal) o fibrinógeno disminuido (<1.5g /L)
- Se recomienda concentrado de fibrinógeno o crioprecipitado en pacientes con hipofibrinogenemia severa (<1.5g/L)
- Se recomienda concentrado de complejo de protrombina si no es posible la transfusión de PFC.
- Acido tranexamico no debe usarse de manera rutinaria en CID asociada a COVID-19.
Alteplasa (tPa) [10]
Serie de casos de 3 pacientes ventilados mecánicamente con SDRA por COVID-19 + uso de tPA
- Caso 1:
- Valores iniciales:
- Relación P/F = 73
- Nivel de dímero D> 50.000 ng/mL
- Niveles de fibrinógeno 375 – 541 mg/dL
- El día 8 relación P / F 140 – 240
- Se administraron 25 mg de tPA IV a pasar durante 2 horas seguidas de una infusión de 25 mg durante 22 horas.
- Sin sangrado u otras complicaciones.
- 11 horas en infusión de tPA La relación P/F mejoró a 408
- Después de la infusión con tPA se comenzó con la infusión de heparina 10U/kg/h con un objetivo en PTT de 60 – 80.
- 1 hora en infusión de heparina = relación P / F = 136
- 48 horas después de la tPA la relación P/F: 188 – 250
- Fibrinógeno = 351 mg / dL
- Dímero D = 16,678 ng / mL
- Pt se convirtió en no resucitable (DNR) y murió poco después.
Caso 2:
- Valores iniciales:
- Relación P / F = 82 (supino) y 130 (pronado)
- Dímero D = 545 ng / ml y aumentó a 20,293 ng/ml para el día 9
- Fibrinógeno = 939 mg / dL
- tPA IV administrado a 25 mg IV a pasar durante 2 horas, seguido de 25 mg durante 22 horas posteriores.
- No sangrado u otras complicaciones.
- Después del tPA, se comenzó con la infusión con heparina 10U / kg / h con un objetivo de PTT de 60 – 80.
- A las 4 horas de infusión de heparina, relación P / F = 135 (pronado)
- Dímero D: 40,490 mg / mL
- Relación P / F mejorada a 135 (supina)
Caso3:
- Valores iniciales:
- Relación P / F = 120 (pronado) y 72-90 (supino)
- Dímero D = 33,228 ng / mL
- Fibrinógeno 874 mg / dL
- El día 2 se administraron 25 mg de tPA a pasar durante 2 horas seguidas de una infusión de 25 mg durante 22 horas
- Después de que el tPA, se reinicia con la infusión de heparina 10U/ kg / h con un objetivo PTT de 60 – 80.
- 3 horas después de la relación tPA P / F 125
- Sin sangrado ni complicaciones.
- 33 horas después de la infusión de tPa:
- Relación P / F 71 (supina) y 118 (pronado)
- Dímero D = 37,215 ng / mL
- Fibrinógeno = 544 mg / dL
Conclusión: los 3 pacientes tuvieron una mejora inicial de la relación P / F después de tPA, sin embargo, las mejoras fueron transitorias y se perdieron con el tiempo en los 3 pacientes.
Hemoglobina (esta sección es teórica en este momento y se desconoce su relevancia clínica):
- Hb tiene 4 subunidades
- 2-alfa
- 2-beta
- Cada subunidad tiene un heme unido a hierro
- Heme = Porfirina que contiene hierro
- Sin hierro llamado porfirina
- El hierro divalente Hb puede liberar CO2 y capturar O2 que forma hierro trivalente
- Cuando la Hb libera O2, el hierro se vuelve divalente
- Se usó un estudio que utilizó modelos de homología de análisis de dominio conservado y acoplamiento molecular para comparar los roles biológicos de ciertas proteínas del virus SARS-CoV-2 y su interacción con la hemoglobina [3]
- La proteína ORF8 y la glicoproteína de superficie se unen a la porfirina respectivamente
- Las proteínas Orf1 ab, ORF10 y ORF3a atacan el heme en la cadena 1-beta de la hemoglobina para disociar el hierro y formar porfirina.
- Esto reduce la capacidad de la hemoglobina para transportar oxígeno y dióxido de carbono.
- El SARS-CoV-2 se une a la porfirina y ataca al heme en la cadena Beta-1 de Hb -> disocia el hierro del heme -> Hb con disminución de la afinidad por O2 -> la curva de disociación de O2 se desplaza hacia la derecha -> liberación de O2
Razones por las cuales esta teoría es probablemente errónea:
- No está claro cómo el SARS-CoV-2 entraría en los glóbulos rojos
- Los glóbulos rojos no tienen ADN
- La hemoglobina tiende a causar hemólisis cuando se altera.
- Esto probablemente juega un papel muy pequeño en las bajas saturaciones de oxígeno, ya que la SpO2 parece coincidir con la PaO2 en los gases arteriales.
Esto solo en referencia [12] …
- Los autores de estos documentos dan muchas razones por las cuales el estudio anterior debe considerarse erróneo. Dos de las razones más importantes se enumeran a continuación:
- El documento anterior [3] es un experimento computacional sin evaluar adecuadamente la importancia clínica o considerar explicaciones alternativas
- Los estudios de acoplamiento utilizados para evaluar las interacciones moleculares, sin embargo, hay un gran error … el acoplamiento utilizado se evaluó en función de la energía más alta, pero las moléculas / complejos más estables son los que usan la energía más baja.
Bibliografía:
- Chen J et al. Findings of Acute Pulmonary Embolism in COVID-19 Patients. Lancet 2020. [Epub Ahead of Print]
- Zhang Y et al. Coagulopathy and Antiphospholipid Antibodies in Patients with COVID-19. NEJM 2020. [Epub Ahead of Print]
- COVID-19: Attacks the 1-Beta Chain of Hemoglobin and Captures the Porphyrin to Inhibit Human Heme Metabolism. ChemRxiv Preprint 2020. [Epub Ahead of Print]
- Zhou F et al. Clinical Course and Risk Factors for Mortality of Adult Inpatients with COVID-19 in Wuhan, China: A Retrospective Cohort Study. Lancet 2020. PMID: 32171076
- Tang N et al. Anticoagulant Treatment is Associated with Decreased Mortality in Severe Coronavirus Disease 2019 Patients with Coagulopathy. J Thromb Haemost 2020. PMID: 32220112
- Cui S et al. Prevalence of Venous Thromboembolism in Patients with Severe Novel Coronavirus Pneumonia. Journal of Thrombosis and Haemostasis 2020. [Epub Ahead of Print]
- Thachil J et al. ISTH Interim Guidance on Recognition and Management of Coagulopathy in COVID-19. Journal of Thrombosis and Haemostasis 2020. [Epub Ahead of Print]
- Klok FA et al. Incidence of Thrombotic Complications in Critically Ill ICU Patients with COVID-19. Thrombosis Research. [Epub Ahead of Print]
- Fox SE et al. Pulmonary and Cardiac Pathology in COVID-19: The First Autopsy Series from New Orleans. Chemrxiv Pre-Print 2020. [Epub Ahead of Print]
- Wang J et al. Tissue Plasminogen Activator (tPA) Treatment for COVID-19 Associated Acute Respiratory Distress Syndrome (ARDS): A Case Series. J Thromb Haemost 2020. PMID: 32267998
- Bikdeli B et al. COVID-19 and Thrombotic or Thromboembolic Disease: Implications for Prevention, Antithrombotic Therapy, and Follow-Up. JACC 2020. [Epub Ahead of Print]
- Read RJ et al. Flawed Methods in “COVID-19: Attacks the 1-Beta Chain of Hemoglobin and Captures the Porphyrin to Inhibit Human Heme Metabolism” ChemRxiv Prepring 2020 [Epub Ahead of Print]
- Dolhnikoff M et al. Pathological Evidence of Pulmonary Thrombotic Phenomena in Severe COVID-19. Journal of Thrombosis and Haemostasis 2020. [Epub Ahead of Print]
- Tavazzi G et al. Thrombotic Events in SARS-CoV-2 Patients: An Urgent Call for Ultrasound Screening. Intensive Care Med 2020. PMID: 32322918
- Helms J et al. High Risk of Thrombosis in Patients in Severe SARS-CoV-2 Infection: A Multicenter Prospective Cohort Study. Intensive Care Medicine 2020 [Epub Ahead of Print]
- COVID-19: Autopsy Studies & Venous Thromboembolism